NGHIÊN CỨU SỬ DỤNG RHODOBACTER XỬ LÝ H2S CỦA TRƯỜNG ĐẠI HỌC SÀI GÒN
KHOA KHOA HỌC MÔI TRƯỜNG
Chủ nhiệm đề tài: ThS. Mỵ Trần Hương Trà
Thành viên tham dự: ThS. Dương Thị Giáng Hương
CN : Vũ Thị Thúy
TÓM TẮT ĐỀ TÀI
Qua quá trình thực hiện, chúng tôi đã nhân nuôi thành công chủng vi khuẩn quang hợp tía không lưu huỳnh chi Rhododbacter này trong môi trường SA ở điều kiện không sục khí dưới ánh sáng tự nhiên. Sau 14 ngày, sự tăng trưởng sinh khối của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter được xác định tại bước sóng 862nm đạt độ hấp thụ cực đại 1.268Abs (665.320 tế bào/ mm3).
Chủng vi khuẩn này có thể sinh trưởng và thích nghi với các độ mặn được khảo sát là 0, 5, 10, 15, 20, 25, 30, 35‰. Chúng sinh trưởng tốt nhất ở các độ mặn từ 0 -20‰ và trong điều kiện không sục khí dưới ánh sáng tự nhiên chủng phát triển tốt hơn các điều kiện còn lại.
Khả năng xử lý chất hữu cơ trong môi trường nước thải nuôi trồng thủy sản giả định của chủng vi sinh vật này là khá cao, với hiệu suất xử lý từ 58 – 87% trong điều kiện không sục khí dưới ánh sáng tự nhiên và che tối. đạt Sau 10 ngày theo dõi với các hàm lượng chất hữu cơ 20, 50, 100, 300, 400mgC/L, hiệu suất xử lý đạt từ 51 – 73%.
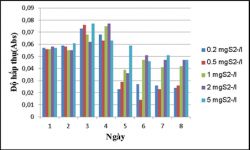
Hiệu suất xử lý Sulfide trong môi trường nước thải nuôi trồng thủy sản giả định của chủng vi sinh vật này sau 7 ngày theo dõi trong điều kiện không sục khí dưới ánh sáng tự nhiên và che tối là từ 86.7-100%, gần như loại bỏ hoàn toàn sulfide. Hiệu suất xử lí Sulfide đạt 100% sau 4 ngày theo dõi trong điều kiện sục khí dưới ánh sáng tự nhiên, và hiệu suất này cũng đạt 100% sau 7 ngày theo dõi trong
điều kiện sục khí che tối với các nồng độ được khảo sát là 0.2, 0.5, 1.0.0, 2 và 5.0 mgS2-/L.
Kết quả của đề tài này cho thấy có thể nhân nuôi rộng rãi và ứng dụng chủng vi khuẩn này để xử lý nước thải ô nhiễm chất hữu cơ và SULFIDE.
MỞ ĐẦU
I. LÝ DO CHỌN ĐỀ TÀI
Xử lý chất hữu cơ bằng công nghệ vi sinh đã được nghiên cứu và khá hoàn thiện trong các công trình xử lý nước thải tập trung cũng như xử lý môi trường trong nuôi thủy sản bằng các vi sinh vật có chức năng xử lý chất hữu cơ.
Đằng sau quá trình xử lý thường xuất hiện chất độc hại đặc biệt là khí sulfide, NH3… đây là kẻ thù số một gây chết đối với động vật trong nuôi trồng thủy sản cũng như là chất gây mùi hôi thối.
Xử lý mùi hôi thối do sulfide gây ra từ công nghệ xử lý nước thải kỵ khí đang là vấn đề vô cùng khó khăn đối với các nhà máy xử lý nước thải.
Ở các nước Đức, Mỹ, Nhật Bản nhóm vi khuẩn quang hợp Phototrophic Bacteria đã được nghiên cứu từ rất lâu và được ứng dụng để đưa vào các ao nuôi trồng thủy sản. Việc đưa chúng vào ao nuôi thủy sản có nhiều tác dụng:
• Chuyển hóa các chất độc sulfide, NH4+ thành chất không độc hay ít độc hơn đối với động vật.
• Tham gia vào phân hủy chất hữu cơ.
• Là thức ăn của nhiều động vật hình thành chuỗi thức ăn cho ao nuôi.
Ở nước ta cũng đã có những nghiên cứu và ứng dụng về nhóm vi khuẩn quang hợp Phototrophic Bacteria nhưng chủ yếu về sản xuất chế phẩm sinh học và sử dụng chúng làm thức ăn cho thủy hải sản những nghiên cứu về sử dụng vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter còn hạn chế vì vậy đề tài “Nghiên cứu nhân nuôi và sử dụng vi khuẩn Rhodobacteria để xử lý chất hữu cơ và Sulfide trong nước” được thực hiện nhằm:
Nhân nuôi thành công vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter.
Xác định khả năng sinh trưởng và xử lý chất hữu cơ và sulfide của chủng vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong các môi trường nước thải thủy sản giả định có nồng độ chất ô nhiễm khác nhau trong điều kiện không sục khí, sục khí dưới ánh sáng tự nhiên và che tối. Từ đó đưa ra các giải pháp phù hợp để xử lý nước thải ô nhiễm hữu cơ đặc biệt nước trong nuôi trồng thủy sản thân thiện với môi trường.
II. ĐỐI TƯỢNG VÀ PHẠM VI NGHIÊN CỨU
II.1. Đối tượng nghiên cứu
Môi trường nghiên cứu: nước thải nuôi trồng thủy sản giả định chứa sulfide, chất hữu cơ.
Đối tượng sử dụng nghiên cứu: vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter được cung cấp từ Viện Vi sinh vật học Ứng dụng – Trường đại học Quốc Gia Hà Nội đã phân lập và tuyển chọn tại các khu đầm nuôi thủy sản ở Cần Giờ thành phố Hồ Chí Minh.
II.2. Phạm vi nghiên cứu
• Nghiên cứu khả năng nhân nuôi vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter và thử nghiệm sử dụng chúng trong xử lý nước thải giả định nuôi trồng thủy sản ô nhiễm chất hữu cơ và sulfide trên quy mô phòng thí nghiệm.
• Nghiên cứu được thực hiện tại phòng thí nghiệm khoa Khoa học Môi trường trường Đại học Sài Gòn.
III. NHIỆM VỤ NGHIÊN CỨU
• Nghiên cứu nhân nuôi vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trên quy mô phòng thí nghiệm.
• Nghiên cứu khả năng sinh trưởng và xử lý sulfide, chất hữu cơ trong nước thải giả định nuôi trồng thủy sản của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong điều kiện không sục khí dưới ánh sáng tự nhiên và che tối.
• Nghiên cứu khả năng sinh trưởng và xử lý sulfide, chất hữu cơ trong nước thải của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong điều kiện sục khí dưới ánh sáng tự nhiên và che tối.
IV. MỤC TIÊU CỦA ĐỀ TÀI
• Nhân nuôi được vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong điều kiện không sục khí dưới ánh sáng tự nhiên.
• Khảo sát sự phát triển của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter ở các độ mặn khác nhau trong điều kiện không sục khí và có sục khí dưới ánh sáng tự nhiên và che tối.
• Nghiên cứu, đánh giá được khả năng xử lý chất hữu cơ và sulfide trong nước thải của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong điều kiện không sục khí, có sục khí dưới ánh sáng tự nhiên và che tối.
V. NỘI DUNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
V.1. Nội dung nghiên cứu
Nội dung 1: Nhân nuôi vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter, xây dựng mối liên hệ giữa mật độ vi khuẩn và độ hấp thụ (Abs).
Bố trí thí nghiệm: Theo dõi trong 14 ngày.
Nhân nuôi vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong môi trường dinh dưỡng thích hợp.
Tiến hành đếm vi khuẩn và đo độ hấp thụ của dịch tế bào từ đó xây dựng mối liên hệ giữa mật độ vi khuẩn và độ hấp thụ (Abs).
Nội dung 2: Khảo sát tốc độ phát triển của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trên môi trường có độ mặn khác nhau từ 0 – 35‰ trong điều kiện không sục khí dưới ánh sáng tự nhiên và che tối.
Bố trí thí nghiệm: theo dõi trong 7 ngày.
Nuôi vi khuẩn trong điều kiện môi trường có độ mặn 0, 5, 10, 15, 20, 25, 30, 35‰ (Từ TN1 đến TN8) trên 2 điều kiện:
– Dưới ánh sáng tự nhiên không sục khí.
– Che tối không sục khí.
Các yếu tố theo dõi:
– Mật độ vi khuẩn hình thành theo ngày.
– Xác định được độ mặn mà vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter phát triển tốt.
Độ lặp: thí nghiệm được lặp lại 3 lần. Nội dung 3:
Thử nghiệm đánh giá khả năng xử lý chất ô nhiễm hữu cơ khi bổ sung vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong điều kiện không sục khí dưới ánh sáng tự nhiên.
Thử nghiệm đánh giá khả năng xử lý chất ô nhiễm hữu cơ khi bổ sung vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong điều kiện không sục khí che tối.
Bố trí thí nghiệm :
Sử dụng độ mặn thích hợp tiến hành nghiên cứu và đánh giá khả năng xử lý chất hữu cơ trên độ mặn thích hợp bao gồm:
Nguồn nước có chất hữu cơ bằng cách bổ sung glucose tương đương 20, 50, 100, 300, 400mgC/L trên 2 điều kiện thí nghiệm:
– Dưới ánh sáng tự nhiên không sục khí.
– Che tối không sục khí.
Các yếu tố theo dõi: theo dõi trong 10 ngày.
– Mật độ vi khuẩn hình thành theo ngày.
– Hàm lượng chất hữu cơ còn trong môi trường theo ngày.
– Xác định được hàm lượng chất hữu cơ mà vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter sinh trưởng và xử lý tốt.
Độ lặp: thí nghiệm được lặp lại 3 lần.
Nội dung 4:
Thử nghiệm, đánh giá khả năng xử lý sulfide khi bổ sung vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong điều kiện không sục khí dưới ánh sáng tự nhiên.
Thử nghiệm, đánh giá khả năng xử lý sulfide khi bổ sung vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong điều kiện không sục khí che tối.
Bố trí thí nghiệm
Sử dụng điều kiện độ mặn thích hợp và hàm lượng chất hữu cơ thích hợp cho sinh trưởng của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter để tiến hành nghiên cứu đánh giá khả năng xử lý S2- bao gồm:
Nguồn nước có độ mặn thích hợp, hàm lượng chất hữu cơ thích hợp và hàm lượn S2- bằng cách bổ sung Na2S tương đương 0.2, 0.5, 1, 2, 5 mgS2-/L trên 2 điều kiện thí nghiệm:
– Dưới ánh sáng tự nhiên không sục khí
– Che tối không sục khí
Các yếu tố theo dõi: theo dõi trong 7 ngày.
– Mật độ vi khuẩn hình thành theo ngày
– Hàm lượng S2- còn lại trong môi trường theo ngày
Độ lặp: thí nghiệm được lặp lại 3 lần.
Nội dung 5: Khảo sát tốc độ phát triển của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trên môi trường có độ mặn khác nhau từ 0 – 35‰ trong điều kiện sục khí dưới ánh sáng tự nhiên và che tối.
Bố trí thí nghiệm:
Nuôi vi khuẩn trong điều kiện môi trường có độ mặn 0, 5, 10, 15, 20, 25, 30, 35‰ trên 2 điều kiện:
– Dưới ánh sáng tự nhiên sục khí.
– Che tối sục khí.
Các yếu tố theo dõi: theo dõi trong 7 ngày.
– Mật độ vi khuẩn hình thành theo ngày.
– Xác định được độ mặn mà vi khuẩn quang hợp tía không lưu huỳnh chi. Rhodobacter phát triển tốt.
Độ lặp: thí nghiệm được lặp lại 3 lần. Nội dung 6:
Đánh giá khả năng xử lý chất ô nhiễm HC khi bổ sung VKQH tía không lưu huỳnh chi Rhodobacter với điều kiện sục khí dưới ánh sáng tự nhiên.
Thử nghiệm đánh giá khả năng xử lý chất ô nhiễm hữu cơ khi bổ sung vkqh tía không lưu huỳnh chi Rhodobacter trong điều kiện sục khí che tối.
Bố trí thí nghiệm:
Sử dụng độ mặn thích hợp tiến hành nghiên cứu và đánh giá khả năng xử lý chất hữu cơ trên độ mặn thích hợp bao gồm:
Nguồn nước có chất hữu cơ bằng cách bổ sung glucose tương đương 20, 50, 100, 300, 400mgC/L trên 2 điều kiện thí nghiệm:
– Dưới ánh sáng tự nhiên sục khí.
– Che tối sục khí.
Các yếu tố theo dõi: theo dõi trong 10 ngày.
– Mật độ vi khuẩn hình thành theo ngày.
– Hàm lượng chất hữu cơ còn trong môi trường theo ngày.
– Xác định được hàm lượng chất hữu cơ mà vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter sinh trưởng và xử lý tốt.
Độ lặp: thí nghiệm được lặp lại 3 lần. Nội dung 7:
Thử nghiệm, đánh giá khả năng xử lý sulfide khi bổ sung VKQH tía không lưu huỳnh chi Rhodobacter trong điều kiện sục khí dưới ánh sáng tự nhiên.
Thử nghiệm, đánh giá khả năng xử lý sulfide khi bổ sung vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong điều kiện sục khí che tối.
Bố trí thí nghiệm
Sử dụng điều kiện độ mặn thích hợp và hàm lượng chất hữu cơ thích hợp cho sinh trưởng của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter để tiến hành nghiên cứu đánh giá khả năng xử lý S2- bao gồm:
Nguồn nước có độ mặn thích hợp, hàm lượng chất hữu cơ thích hợp và hàm lượn S2- bằng cách bổ sung Na2S tương đương 0.2, 0.5, 1, 2, 5 mgS2-/L trên 2 điều kiện thí nghiệm:
– Dưới ánh sáng tự nhiên sục khí.
– Che tối sục khí.
Các yếu tố theo dõi: theo dõi trong 7 ngày.
– Mật độ vi khuẩn hình thành theo ngày.
– Hàm lượng S2- còn lại trong môi trường theo ngày.
Độ lặp: thí nghiệm được lặp lại 3 lần.
V.2. Phương pháp nghiên cứu
Phương pháp kế thừa: sử dụng chọn lọc các kết quả nghiên cứu từ các công trình nghiên cứu trước đây.
Phương pháp so sánh: trên cơ sở kết quả khảo sát, đo đạc,… thực hiện việc so sánh giữa các điều kiện thí nghiệm khác nhau, so sánh với các nghiên cứu khác…
Phương pháp phân tích thống kê và tổng hợp số liệu bằng phần mềm thống kê và excel.
Phương pháp thực nghiệm trên mô hình thực tế.
VI. Ý NGHĨA CỦA ĐÈ TÀI
Đây là một trong những hướng nghiên cứu khá mới ở Việt Nam nhằm tiến tới phát triển và hoàn thiện công nghệ vi sinh trong xử lý nước cho các ao nuôi thủy sản thâm canh, các nhà máy xử lý nước thải, các hồ tự nhiên, hệ thống kênh rạch đang bị ô nhiễm nghiêm trọng do chất hữu cơ và mùi hôi thối,…
Kết quả của đề tài không chỉ có ý nghĩa về mặt khoa học mà còn có khả năng phát triển để ứng dụng vào trong thực tiễn.
CHƯƠNG 1. TỔNG QUAN VỀ CÁC VẤN ĐỀ NGHIÊN CỨU
1.1. TỔNG QUAN VỀ NUÔI TRỒNG THỦY SẢN Ở VIỆT NAM
1.1.1. Tình hình nuôi trồng thủy sản
Nước ta với hệ thống sông ngòi dày đặc và có đường biển dài hơn 3,260 km, nên rất thuận lợi phát triển hoạt động khai thác và nuôi trồng thủy sản. Hoạt động nuôi trồng thủy sản ở nước ta thực sự khởi sắc từ năm 1990 và đến năm 2000 – 2002 thì bùng phát cả về diện tích lẫn đối tượng nuôi. Việc mở rộng diện tích nuôi trồng thủy sản được tiến hành chủ yếu trên các vùng đất ngập nước ven biển, trong các thủy vực nước mặn ven bờ, trên các vùng cát trũng thấp ven biển miền Trung và một phần diện tích từ canh tác nông nghiệp kém hiệu quả đã được chuyển sang nuôi trồng thủy sản.
Sản lượng thủy sản của Việt Nam năm 2008 đạt trên 4.5 triệu tấn, gấp trên 6 lần so với năm 1980, trong đó nuôi trồng thủy sản là 2.45 triệu tấn, gấp hơn 12 lần so với 1980 và gấp 4.8 lần so với năm 1999. Tốc độ tăng trưởng trung bình sản lượng nuôi trồng thủy sản trong 10 năm qua đạt 19.83%/năm. Giá trị kim ngạch xuất khẩu thủy sản năm 2008 đạt trên 4.5 tỷ USD, đứng thứ tư trong những ngành hàng có xuất khẩu cao nhất của cả nước. Trong tổng giá trị kim ngạch xuất khẩu thủy sản thì giá trị xuất khẩu thủy sản nuôi trồng luôn có xu hướng tăng lên. Năm 2000, giá trị kim ngạch xuất khẩu của nuôi trồng thủy sản chỉ chiếm 41.51%, đến năm 2007-2008, đã tăng lên 57.78% trong tổng kim ngạch xuất khẩu thủy sản của cả nước. (Nguồn: Bộ Nông nghiệp và Phát triển Nông thôn ).
Hình 1.1. Diện tích và sản lượng thuỷ sản nuôi trồng từ 1991-2005.
(Nguồn: Báo cáo tổng kết hàng năm của Bộ Thủy sản ) Bảng 1.1. Sản lượng thủy sản Việt Nam năm 2012.
Bảng 1.1. Sản lượng thủy sản Việt Nam năm 2012.
| Năm | 2011 | 2012 | tăng/giảm (%) |
| Tổng sản lượng thủy sản ( nghìn tấn ) | 5,417 | 5,876 | 8.5% |
| Khai thác thủy sản | 2,420 | 2,676 | 10.6% |
| Trong đó: Khai thác hải sản | 2,226 | 2,483 | 9.6% |
| Khai thác nội địa | 154 | 193 | 25.3% |
| Tổng sản lượng nuôi trồng (nghìn tấn) | 2,997 | 3,200 | 6.8% |
| Trong đó: Tôm | 496 | 500 | 0.9% |
| Cá tra | 1,151 | 1,190 | 3.4% |
| Khác | 1,350 | 1,510 | 10.6% |
| Diện tích nuôi trồng (ha) | 1,200,000 | 1,200,000 | 0.0% |
| Trong đó: Tôm | 656,000 | 658,000 | 0.3% |
(Nguồn: Trung tâm thông tin thủy sản, Cục Thủy sản)
Sản lượng thủy sản Việt Nam đã duy trì tăng trưởng liên tục qua các năm với chủ trương thúc đẩy phát triển của chính phủ, hoạt động nuôi trồng thủy sản đã có những bước phát triển mạnh, sản lượng liên tục tăng cao trong các năm qua, đóng góp đáng kể vào tăng trưởng tổng sản lượng thủy sản của cả nước cũng như ngân sách quốc gia.
1.1.2. Các tác động của nước thải nuôi trồng thủy sản đến môi trường
Đồng hành với sự tăng trưởng của nuôi trồng thủy sản lại là những cảnh báo ngày càng gia tăng về tác động xấu đến môi trường do sự phát triển quá nóng, thiếu quy hoạch, thiếu bền vững của nuôi trồng thủy sản.
Một số vấn đề môi trường nảy sinh trong hoạt động nuôi trồng thủy sản ở nước ta:
– Do thiếu quy hoạch, nuôi trồng thủy sản (NTTS) ven biển phát triển khá tự phát và ồ ạt, quy mô và phương thức nuôi cũng rất đa dạng, chủ yếu vẫn là quảng canh, tăng cường mở rộng diện tích. Cho nên đã phá hủy phần lớn các nơi cư trú của các loài ở vùng ven biển, thu hẹp không gian vùng ven biển và đẩy môi trường vào tình trạng khắc nghiệt hơn về mặt sinh thái, tăng rủi ro bệnh dịch cho vật nuôi do thiếu các yếu tố có vai trò điều hòa và điều chỉnh môi trường.
– Nuôi trồng thủy sản ven biển tăng nhanh dẫn đến nguồn giống tự nhiên của một số loài cá giống kinh tế cư trú ở các rạn san hô bị đối tượng nuôi lồng bè khai thác cạn kiệt. Điều này làm ảnh hưởng đến chức năng duy trì nguồn lợi tự nhiên của các hệ sinh thái đặc hữu và ảnh hưởng tới khả năng khai thác hải sản tự nhiên của vùng biển.
Việc thiết kế, xây dựng đầm ao NTTS ở vùng cửa sông ven biển dẫn đến những thay đổi về nơi sinh sống của quần xã sinh vật, độ muối, lắng đọng trầm tích và sói lở bờ biển. Một số hoạt động của nghề NTTS không dựa trên các căn cứ khoa
học đã tác động xấu đến nguồn giống thiên nhiên (cá, tôm hùm, cua), làm giảm sức sản xuất tự nhiên và mất tính đa dạng sinh học.
– Tại một số khu vực nuôi tôm, cá tập trung (trong đó có nuôi trên cát), do việc xả thải các chất hữu cơ phú dưỡng, chất độc vi sinh vật (cả mầm bệnh) và các chất sinh hoạt bừa bãi làm cho môi trường suy thoái, bùng nổ dịch bệnh (bệnh tôm năm 1993 – 1994) và gây thiệt hại đáng kể về kinh tế cũng như về điều kiện môi trường sinh thái.
– Lạm dụng nước ngầm để nuôi tôm trên cát, không tuân thủ luật tài nguyên nước đang là hiện tượng khá phổ biến ở vùng cát ven biển miền Trung. Hậu quả lâu dài sẽ làm cạn kiệt nguồn nước ngọt và nước ngầm, ô nhiễm biển và nước ngầm, gây mặn hóa đất và nước ngầm, thu hẹp diện tích rừng phòng hộ, làm tăng hoạt động cát bay và bão cát.
Hai vấn đề môi trường đáng lo ngại nhất hiện tại cho vùng nuôi trồng thủy sản là khai thác nước ngầm quá mức (do nhu cầu nước ngọt dùng để pha với nước biển làm nước nuôi rất lớn) và nước thải gây ô nhiễm cho môi trường xung quanh.
Hiện nay, có rất nhiều loại sản phẩm thuốc, hoá chất và chế phẩm sinh học (CPSH) được dùng rộng rãi trong nuôi trồng thuỷ sản trên thế giới. Hoá chất được dùng trong NTTS trên thế giới thường ở các dạng sau: thuốc diệt nấm (antifoulants), thuốc khử trùng (disinfectants), thuốc diệt tảo (algicides), thuốc trừ cỏ (herbicides), thuốc trừ sâu (pesticides), thuốc diệt ký sinh trùng (parasiticides) và thuốc diệt khuẩn (antibacterials) và chất kháng sinh được sử dụng đáng kể trong NTTS hoặc để chữa các bệnh lây nhiễm hoặc phòng bệnh.
Những hoá chất trên có vai trò quan trọng trong việc bảo vệ sức khoẻ động vật thuỷ sản nếu như sử dụng đúng, nhưng khi lạm dụng dẫn đến những hậu quả khôn lường, gây rủi ro cho người lao động, tồn dư các chất độc trong sản phẩm thuỷ sản gây hại cho người tiêu dùng, làm giảm giá trị thương phẩm và còn tạo các chủng vi khuẩn kháng thuốc làm giảm hiệu quả trong điều trị bệnh.
Thành phần lớp bùn trong các đầm, ao NTTS chủ yếu là các chất hữu cơ như protein, lipids, axit béo với công thức chung CH3(CH2)nCOOH , photpholipid,
Sterol – vitamin D3, các hoocmon, carbohydrate, chất khoáng và vitamin, vỏ tôm lột xác,… Lớp bùn này luôn ở trong tình trạng ngập nước, yếm khí, các vi sinh vật yếm khí phát triển mạnh, phân huỷ các hợp chất trên tạo thành các sản phẩm là sulfide, Amonia (NH3), khí metan (CH4),… rất có hại cho thuỷ sinh vật. Ví dụ nồng độ 1,3 ppm của sulfide có thể gây sốc, tê liệt và thậm chí gây chết tôm. Khí amonia (NH3) cũng được sinh ra từ quá trình phân huỷ yếm khí thức ăn tồn dư gây độc trực tiếp cho tôm, làm ảnh hưởng đến độ pH của nước và kìm hãm sự phát triển của thực vật phù du (Hunter, 2009).
Nước thải từ hoạt động nuôi trồng thủy sản ở nước ta chủ yếu được thải thẳng ra ngoài môi trường, ít qua xử lý. Nước thải chứa thức ăn thừa, chất bài tiết, phân, vi khuẩn gây bệnh, kháng sinh…làm suy giảm chất lượng nước, gây tổn hại sinh cảnh, làm suy giảm đa dạng sinh học, nhiễm mặn đất, lan truyền bệnh, biến đổi gien của vi sinh do kháng sinh và đôi khi gây hiện tượng phú dưỡng cho vực nước nhận (Kobayshi, 1995). Trong quá trình nuôi thủy sản một lượng rất lớn thức ăn, phân vô cơ, phân hữu cơ được đưa vào ao nuôi nhằm tăng năng suất sản phẩm. Hiệu quả sử dụng các thành phần bổ sung này thường khá thấp, ví dụ lượng thức ăn đưa vào chỉ được hấp thu khoảng 25 – 30%. Do vậy nước thải từ các ao nuôi rất giàu các chất hữu cơ (từ thức ăn, phân bón), nitơ, phốtpho (từ phân hủy các prôtêin) và chất rắn lơ lửng. Gây ô nhiễm môi trường và quay ngược lại gây thiệt hại cho người nuôi trồng do thủy sản bị nhiễm bệnh từ nước thải nuôi trồng bị ô nhiễm đã thải ra.
1.2. TỔNG QUAN VỀ VI KHUẨN QUANG HỢP TÍA
1.2.1. Giới thiệu chung về vi khuẩn quang hợp (VKQH)
Nhóm vi khuẩn có khả năng quang hợp nhờ có sắc tố lục. Chất diệp lục vi khuẩn khác với chất diệp lục của thực vật. VKQH không sử dụng nước làm nguồn hidro như thực vật và không tạo ra sản phẩm cuối cùng là oxi. Chúng sử dụng nguồn hidro là sunfit thiosunfat, hidro tự do, chất hữu cơ và sản sinh ra nhiều sản phẩm phụ dạng oxi hóa. Bao gồm: vi khuẩn lưu huỳnh lục, vi khuẩn tía lưu huỳnh và vi khuẩn tía không lưu huỳnh.
Trong phạm vi nghiên cứu của đề tài chỉ sử dụng vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter.
1.2.2. Giới thiệu chung về vi khuẩn quang hợp tía
Vi khuẩn quang hợp tía là các tế bào gram âm, đơn bào, có các dạng cầu, xoắn, hình que ngắn, hình phẩy… đứng riêng rẽ hoặc thành chuỗi. Các loài vi khuẩn quang hợp tía đều sinh sản bằng cách nhân đôi, một số loài sinh sản bằng cách nảy chồi.
Chúng có khả năng chuyển hóa năng lượng mặt trời thành năng lượng hóa học bởi quá trình quang hợp kỵ khí. VKQH tía thường có màu hồng đến màu đỏ tía, sắc tố quang hợp chính là bacteriochlorophyll a hoặc b. Cơ quan quang hợp là màng quang hợp được gắn với màng tế bào.
Năm 1907, Molisch là người đầu tiên phát hiện ra các vi khuẩn có sắc tố màu đỏ và có khả năng quang hợp, nên ông gọi chung vi khuẩn quang hợp này là Rhodobacteria Molisch 1907. Nhóm này gồm hai họ là Thiorhodaceae (những vi khuẩn tía có khả năng hình thành giọt “S” bên trong tế bào) và Athiorhodaceae (là những vi khuẩn tía không có khả năng hình thành giọt “S” bên trong tế bào). Nhóm vi khuẩn tía bao gồm hai họ này sau này được đổi tên là bộ Rhodospirillales và hai họ Choromatiaceae và Rhodospirillaceae.
Bảng 1.2. Một số đặc điểm của vi khuẩn tía
| Đặc điểm | Ví dụ |
|
Nhóm/loài |
§ Vi khuẩn tía lưu huỳnh (grammaproteobacteria)
§ Vi khuẩn tía không lưu huỳnh (alpha-hoặc betaproteobacteria) |
|
Một số loài chính |
§ Vi khuẩn tía lưu huỳnh: Allochromatium vinosum, Thiocapsa roseopersicina.
§ Vi khuẩn tía không lưu huỳnh: Rhodobacter capsulatus, Rhodobacter sphaeroides, Rhodospirillum rubrum, Rhodopseudomonas |
| palustris | |
|
Sắc tố/ màu sắc của huyền phù tế bào |
§ BChl a or b; carotenoids chính: spirilloxanthin, spheroidene, lycopene, rhodopsin và dẫn xuất của chúng.
§ Màu sắc huyền phù tế bào: tía, đỏ tía, đỏ, tía – tím, cam, nâu, vàng nâu(với những loài chứa BChl a), xanh hoặc vàng (với những loài chứa BChl b). |
| Vị trí của sắc tố trong tế bào | § Nằm trong lớp màng sinh chất, được sắp xếp thành dạng ống, dạng màng, dạng túi hoặc dạng phiến lamellae. |
|
Phổ hấp thụ cực đại của tế bào sống |
§ Những loài chứa BChl a: gần 800nm và những vùng có bước sóng từ 815-960 nm;
§ Với những loài chứa BChl b: 835-850 nm và 1010-1040 nm. |
|
Chất cho electron/giọt lưu huỳnh |
2- 2+
§ Sulfide, S0, S2O3 , H2, Fe . § Nếu S0 được hình thành từ quá trình oxy hóa sulfide thì S0 được tích lũy bên trong tế bào, và điều này chỉ xảy ra ở loài vi khuẩn tía có lưu huỳnh. |
| Quang tự dưỡng/hô hấp tối | § Vi khuẩn tía lưu huỳnh bị hạn chế về số lượng.
§ Vi khuẩn tía không lưu huỳnh đa dạng về số lượng. |
Quá trình trao đổi chất ở vi khuẩn quang hợp tía
Trong điều kiện có ánh sáng, vi khuẩn quang hợp tiến hành quang hợp để thu nhận năng lượng sử dụng cho các hoạt động sống của tế bào. Phương trình tổng quát quá trình quang hợp:
CO2 + 2H2A + hV [CH2O]n + 2A + H2O
Ở tảo hay thực vật bậc cao: H2O đóng vai trò của H2A. Ở vi khuẩn quang hợp: H2A có thể là các chất hữu cơ đơn giản các hợp chất khử của lưu huỳnh hoặc hydro phân tử. Trong đó, các chất hữu cơ vừa đóng vai trò làm chất điện tử, vừa làm nguồn cacbon trong quá trình quang hợp dị dưỡng.
Ở ngoài sáng, tất cả các loài vi khuẩn tía không lưu huỳnh đều ưa thích điều kiện sinh trưởng dị dưỡng, sử dụng các chất hữu cơ đơn vừa làm nguồn cho điện tử, vừa làm nguồn cacbon. Nhiều đại diện của họ vi khuẩn này có khả năng sinh trưởng quang tự dưỡng cacbon với sự có mặt nguồn cho điện tử là các hợp chất khử của lưu huỳnh hay H2. Tuy nhiên, khả năng chịu oxy hóa của các chủng rất khác nhau. Trong điều kiện sinh trưởng quang hợp, khả năng dinh dưỡng hô hấp của các loài này bị ức chế do ánh sáng.
Ở điều kiện kỵ khí tối, một số loài như Rhodobacter capsulatus, Rhodospirillum rubrum có thể tồn tại nhờ quá trình trao đổi chất theo kiểu hô hấp kỵ khí với sự có mặt của các chất nhận điện tử như nitrat, nitrit, NO, dimethylsulfua hay trimethylami N-oxit.
Khi quang hợp, chu trình calvin, hệ thống cố định nito, hệ thống DMSO/DMSOR được tế bào sử dụng để duy trì thế oxy hóa khử. Các phản ứng của chu trình calvin cho phép CO2 có chức năng thu nhận các lực khử dư thừa do trao đổi chất các chất hữu cơ như malate, succinate. Do đó, vai trò của chu trình calvin trong suốt quá trình sinh trưởng quang dị dưỡng là giữ thế cân bằng oxy hóa khử trong tế bào. Khi tế bào sinh trưởng trong điều kiện quang tự dưỡng thì vai trò chủ yếu của chu trình calvin là cố định CO2 để tổng hợp các vật liệu tế bào. Chính nhờ tính lưỡng cực này mà chu trình calvin có vai trò điều khiển giữa hai quá trình quang tự dưỡng và quang dị dưỡng.
Đặc điểm sinh thái học của vi khuẩn quang hợp tía
Vi khuẩn quang hợp tía là nhóm vi khuẩn quang dưỡng, sống kỵ khí hoặc kỵ khí tùy tiện trong môi trường có ánh sáng chiếu rọi. Gồm vi khuẩn quang hợp tía lưu huỳnh và vi khuẩn quang hợp tía không lưu huỳnh. Chúng là các vi sinh vật
điển hình, rất phổ biến ở nước ngọt cũng như nước mặn, thường cư trú nhiều trên bề mặt bùn các ao đầm tù, có nhiều bùn cặn các xác động, thực vật.
Họ vi khuẩn tía lưu huỳnh thường được tìm thấy trong các thủy vực nước ngọt hoặc nước mặn có chứa hàm lượng sulfua cao. Ở các độ sâu khác nhau có thể thu nhận được các loài khác nhau. Ngoài ra còn có thể gặp họ vi khuẩn này ở một số thủy vực có điều kiện cực trị như các thủy vực kiềm hóa hoặc các suối nước nóng.
Hệ sinh thái của họ vi khuẩn tía không lưu huỳnh rất đa dạng, có thể gặp chúng trong các ao hồ tù đọng, các vùng đầm nước lợ hoặc mặn. Nơi sống của chúng thường là các thủy vực có hàm lượng chất hữu cơ cao, hàm lượng oxy hòa tan thấp. Ở một số vùng đất axit có thể gặp các chủng thuộc loài Rhodopseudomonas acidophila, Rhodopseudomonas palustris.
1.2.3. Vi khuẩn quang hợp tía không lưu huỳnh ( Nonsulfure purple bacteria ) Là nhóm vi khuẩn quang dị dưỡng hữu cơ ( photoorganoheterotrophs )
thường kỵ khí bắt buộc, một số loài là quang tự dưỡng vô cơ không bắt buộc (trong tối là hóa dị dưỡng hữu cơ – chemoorganoheterotrophs). Tế bào chứa chlorophyl a hoặc b, hệ thống quang hợp chứa các màng hình cầu hay hình phiến ( lamellar ) gắn với màng sinh chất. Nguồn cho điện tử (electron donors) trong quang hợp thường sử dụng chất hữu cơ, đôi khi sử dụng hợp chất lưu huỳnh dạng khử hoặc H2. Vi khuẩn không lưu huỳnh màu tía có khả năng di động với tiên mao mọc ở cực, hoặc không di động, một số loài có túi khí, tỷ lệ G+C là 61-72% (Nguyễn Lân Dũng, 2005).
Bảng 1.3. Một số đặc tính đặc trưng ở vi khuẩn quang hợp tía không lưu huỳnh
|
Loài |
Hình dạng tế bào |
Màng tế bào ICM |
Carotenoid chính |
Sản phẩm oxy hóa sulfide |
Nhân tố tăng trưởng |
Môi trường nước thích hợp | Đặc tính phân biệt khác | |
| Rhodospirillum rubrum | Xoắn | Túi | Sp,rv | S0 | b | Ngọt | – | |
| Photometricum | Xoắn | Cụm | Rv, rh | – | YE | Ngọt | – |
| Molischianum | Xoắn | Cụm | Ly, rh | – | AA | Ngọt | – | |
| Fulvum | Xoắn | Cụm | Ly, rh | – | p-aba | Ngọt | – | |
| Salexigens | Xoắn | Phiến | Sp | – | glutamat | Mặn | Cần NaCl | |
| Slinarum | Xoắn | Túi | Sp | – | YE | Mặn | Cần NaCl | |
| Mediosalinum | Xoắn | Túi | Sp | S0 | T,p-a,ba, n | Mặn | Cần NaCl | |
| Rhodophila globioformis | Cầu | Túi | Kts | – | B, p-aba | Ngọt | pH axit | |
| Rhodomicrobium vannielii | Gậy ngắn | Phiến | Rh, ly, sp | + | Không | Ngọt | pH axit | |
| Rhodobacter Blastica | Gậy | Phiến | Sn, se | – | B12, b, n,
t |
Ngọt | – | |
| Capsulatus | Gậy | Túi | Sn, se | S0 | T, b, n | Ngọt | – | |
| Velkampii | Gậy | Túi | An, se | S0/sul | B, t, p-aba | Ngọt | Không di động | |
| sphaeroidis | Gậy ngắn | Túi | Sn, se | S0/sul | B,t,n | Ngọt | – | |
| Sulfidophilus | Gậy | Túi | Sn, se | – | B,t,n,p- | Biển | Cần NaCl | |
| Euryhalinus | Gậy | Túi | Se | – | aba | Biển | Cần NaCl | |
| Aduriatacus | Gậy | Túi | Sn, se | – | B,t,n,p- aba | Biển | Cần NaCl | |
| Rhodocyclus purpureus | Bán vòng | ống | Ra, rh | – | B12 | Ngọt | Không di động | |
| Tenuis | Xoắn | ống | Ly, rh. Ra | – | Không | Ngọt | – | |
| Rubriviax | Gậy | ống | Sn, se | – | B,t | Ngọt | – |
| gelatinosa | ||||||||
| Rhodopseudomonas palustris | Gậy | Phiến | Sp,rv,rh | sul | p-aba, b | Ngọt | – | |
| Viridis | Gậy | Phiến | Neu*, ly* | – | p-aba,b | Ngọt | Bchlb | |
| Sulfidoviridis | Gậy | Phiến | Neu,sp | + | p-aba, b | Ngọt | Bchlb | |
| Acidophila | Gậy | Phiến | Rh,rg,rag | – | Không | Ngọt | pH axit | |
| Rutila | Gậy | Phiến | Sp,rv | – | Không | Ngọt | – | |
| Marina | Gậy | Phiến | Sp | + | o | Biển | Cần NaCl |
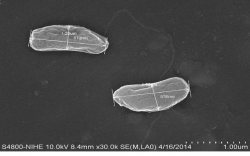
Hình 1.2. Ảnh SEM của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter.
Vi khuẩn không lưu huỳnh màu tía là nhóm vi sinh vật có sinh lý linh hoạt, có thể phát triển quang dưỡng và trong bóng tối. Chúng có thể sử dụng nguồn carbon vô cơ hoặc hữu cơ. Nếu tăng trưởng là quang tự dưỡng thì H2, sunfua ở nồng độ thấp được sử dụng làm nguồn cho điện tử trong quang hợp. Một vài loài có thể sử
dụng thiosulfate hoặc Fe2+ là nguồn cho điện tử (Ehrenreich và cs, 1994; Brune, 1995).
Tuy nhiên, hầu hết vi khuẩn không lưu huỳnh màu tía phát triển tốt nhất trong môi trường dị dưỡng. Đó là môi trường có chứa một số hợp chất hữu cơ dễ sử dụng, chẳng hạn như malate hoặc pyruvat và ammoniac là nguồn nitơ (Sojka, 1978). Ngoài ra, một số vi khuẩn không lưu huỳnh màu tía có thể phát triển trong điều kiện thiếu oxy, trong bóng tối bằng cách lên men hoặc hô hấp kỵ khí (Hunter và cs, 2009).
1.2.4. Ảnh hưởng của các nhân tố lý hóa đến sinh trưởng của vi khuẩn quang hợp tía không lưu huỳnh
a. pH
Quang hợp của vi khuẩn tía có thể xảy ra trong môi trường có pH 3 – 11 (Hunter và cs, 2009). Vi khuẩn tía sinh trưởng và phát triển ở pH tối ưu khoảng 6 – 7.
b. Cường độ ánh sáng
Vi khuẩn lưu huỳnh màu tía sử dụng ánh sáng để quang hợp, phát triển mạnh ở môi trường có ánh sáng đỏ. Vi khuẩn không lưu huỳnh màu tía có thể phát triển quang dưỡng và trong bóng tối (Hunter và cs, 2009).
c. Nhiệt độ
Quang hợp của vi khuẩn tía có thể xảy ra ở nhiệt độ lên tới 570C và xuống tới 00C (Castenholz và Pierson, 1995). Nhiệt độ tối ưu cho sự sinh trưởng và phát triển của vi khuẩn tía ở 300C.
d. Các yếu tố khác
Nhiều loài vi khuẩn tía có thể sinh trưởng quang dưỡng với sulfide như là chất cho điện tử với nồng độ nhỏ hơn 2 mM (tương đương 64mgS2-/L). Nếu trong môi trường sống có nồng độ sulfide quá cao sẽ ức chế sự sinh trưởng của chúng (Hunter và cs, 2009). Ngoài ra, nồng độ NaCl trong môi trường cũng ảnh hưởng tới sự sinh trưởng của vi khuẩn tía. Có loài sống được trong môi trường nước biển có độ mặn từ 8 – 11%NaCl (Mack và cs, 1993).
1.2.5. Ứng dụng của VKQH tía
Những ứng dụng nổi bật của VKQH tía là xử lý nước thải, cải thiện môi trường, sản xuất hydro phân tử, sinh khối. Các VKQH tía nói chung là nguồn cung cấp các thành phần của chuỗi truyền điện tử trong quang hợp và tạo ATP, nguồn vitamin và các phân tử hữu cơ khác.
Sản xuất protein đơn bào
VKQH là nguồn cung cấp protein đơn bào có giá trị vì sinh khối VKQH giàu protein, vitamin và carotenoid. Ở tế bào VKQH hàm lượng protein thường chiếm 60
– 70% trọng lượng khô, số lượng cũng như hàm lượng các axit amin không thay thế của chúng có thể tương đương với đậu tương, thịt, trứng gà.
Sinh khối VKQH giàu vitamin, axit amin thiết yếu và axit amin có lưu huỳnh là nguồn thức ăn tốt cho gia súc, phiêu sinh vật và tôm cá. Giá trị dinh dưỡng của VKQH khi bổ sung vào thức ăn chăn nuôi đã được chứng minh trong thực tiễn. Mức độ sống sót của cá giống tốc độ sinh trưởng và trọng lượng của chúng được gia tăng khi nuôi bằng thức ăn có bổ sung tế bào VKQH. Việc bổ sung sinh khối của VKQH vào thức ăn của gà mái đã giúp cải thiện số lượng, chất lượng trứng gà.
Sản xuất ubiquinone
Ubiquinone 10 (Q10) là thành phần quan trọng của chuỗi vận chuyển điện tử trong hệ quang của VKQH. Q10 được biết đến là loại ubiquinone có giá trị về dược liệu, chúng có tác dụng kích thích cơ tim được sử dụng trong điều trị các bệnh về phổi và còn có thể sử dụng như một chất chống oxy hóa trong sản xuất dược phẩm, mỹ phẩm. Tế bào VKQH tía chứa hàm lượng Q10 cao hơn ở các loài vi sinh vật khác. Thành phần này đã được chiết tách, tinh chế từ Rhodopseudomonas sphaeroides, Rhodopseudomonas sulfidophilus, và Rhodospirillum rubrum.
Sản xuất hoocmon thực vật
Người ta đã phát hiện ra rằng một số hoocmon thực vật cũng có mặt trong tế bào VKQH tía với vai trò điều chỉnh quá trình quang hợp các hoocmon tách ra rừ R.rubrum có hoạt tính sinh lý khá cao và bao gồm ba loại cytokinin (hàm lượng 1mg/g sinh khối tươi) có nguồn gốc adenin. Dịch tế bào R.spharroides đã nuôi cấy
bằng nước thải có chứa kinetin (hàm lượng 4.7g/L) và zeatin với hàm lượng 2g/L. Ngoài ra, người ta cũng tìm thấy một số chất kích thích sinh trưởng khác nhau như auxin, idol-3-axetic axit (IAA), idol-3-butiric axit (ABA) trong tế bào chủng R.sphaeroides IFO 12203.
Sản xuất các chất kháng sinh
Một trong những đặc tính của VKQH là có khả năng sinh các chất kháng sinh vi sinh vật bao gồm: các chất kháng sinh, các chất kháng khuẩn và kháng virus.
Hoạt chất kháng virus có thể được tìm thấy trong khá nhiều chủng thuộc loài R.rubrum, R.capsulatus. C.vinosum. Chất này thường tấn công vào các virus gây bệnh cho cá và các coliphage mà không gây hại cho vật chủ R.capsulatus có thể loại bỏ được 97% coliphage khi sử dụng chúng trong nước thải chăn nuôi.
Sử dụng vi khuẩn quang hợp trong xử lý nước thải
Nước thải chứa hỗn hợp các chất hữu cơ phân tử lượng nhỏ là nguồn cơ chất tốt cho vi khuẩn tía để tăng trưởng trong điều kiện kỵ yếm khí và vi hiếu khí; VKQH thường được ứng dụng cùng với các vi sinh vật dị dưỡng yếm khí, hiếu khí, và vi tảo trong các hệ thống làm sạch nước thải. Các loài thường được sử dụng trong xử lý nước thải là: R.Capsulatus, R.sphaeroides, Rhodopseudomonas palustris, Rhodospirillum fulvum…
Hệ thống xử lý nước thải có sự tham gia của VKQH có những ưu điểm sau:
Không cần thiết phải khử trùng nước sau khi xử lý.
Sinh khối thu được sau quá trình xử lý giàu protein, vitamin, carotenoid và nhiều hoạt chất sinh học khác nên có thể được tái sử dụng trong y học, nông nghiệp và chăn nuôi.
Khi xử lý nước thải đậm đặc hữu cơ bằng vi khuẩn quang hợp tía thì không cần phải pha loãng.
Nói chung, vi khuẩn tía được coi là nhóm quang dưỡng quan trọng bởi vì chúng có thể khử một chất làm hôi môi trường sulfide, và đóng góp vật chất hữu cơ trong các môi trường thiếu ôxy do năng lực tự dưỡng của chúng. Hơn nữa chúng còn có khả năng tiêu thụ các hợp chất hữu cơ, trong đó vai trò của chúng là vi sinh
vật quang dị dưỡng. Ngoài ra, chúng còn là vi sinh vật mô hình cho các nhà khoa học nghiên cứu sự đa dạng phân tử của quá trình quang hợp (Hunter và cs, 2009). Sinh khối của chúng còn được sử dụng để sản xuất các chất có hoạt tính sinh học có giá trị như ubiquinine, các chất kháng sinh, enzyme và làm thức ăn trong chăn nuôi gia cầm và nuôi trồng thủy sản (Sasikala và Ramana, 1995).
Năm 1988, Gadra đã nghiên cứu sử dụng ủng cvi khuẩn quang hợp tía Chlorobiaceae để xử lý Sulfide trong khí biogas với hiệu xuất đạt được 99,9%. Theo nghiên cứu của Chung et al., 1996 khi nồng độ Sulfide từ 10 – 150 ppm thì hiệu quả xử lý của chủng vi khuẩn quang hợp tía Pseudomonas Putida đạt 96% [9]
Ngoài ra, sinh khối của vi khuẩn tía rất giàu protein và vitamin, đặc biệt là vitamin B12. Tại Ấn Độ có công nghệ sản xuất sinh khối của vi khuẩn tía ở dịch ly tâm từ phân gia súc dùng để làm thức ăn (cùng vi tảo) cho tôm hoặc cho ngao đạt hiệu quả rất khả quan. Có lẽ đây là thức ăn rất thích hợp cho thủy sản thân mềm và đang được ưa chuộng trên thị trường thế giới (Lương Đức Phẩm, 1998).
Ở Việt Nam, nhóm vi khuẩn này đã và đang được chú trọng phân lập và tuyển chọn để ứng dụng vào các lĩnh vực khác nhau như xử lý nước thải đậm đặc hữu cơ (Đỗ Thị Tố Uyên và cs, 2003), phân hủy các hydrocacbon mạch vòng (Đinh Thị Thu Hằng và cs, 2003), thu nhận các hoạt chất sinh học có giá trị như ubiquinine (Đỗ Thị Tố Uyên và cs, 2005).
CHƯƠNG 2. VẬT LIỆU, MÔ HÌNH VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. VẬT LIỆU VÀ MÔ HÌNH
2.1.1. Vi khuẩn quang hợp tía
Vi khuẩn Phototrophic Bacteria thuộc chủng Rhodobacter được cung cấp từ Viện Vi sinh vật học Ứng dụng – Trường đại học Quốc Gia Hà Nội đã phân lập và tuyển chọn tại các khu đầm nuôi thủy sản ở Cần Giờ thành phố Hồ Chí Minh.
2.1.2. Môi trường nhân nuôi vi khuẩn
Bảng 2.1. Hỗn hợp môi trường, vi lượng và vitamin dùng trong thí nghiệm nuôi vi khuẩn
| STT | Môi trường nuôi cấy | C* (g/L ) | Dung dịch vi lượng | C* (g/100 mL) | Hổn hợp vitamin | C* (g/100 mL) |
| 1 | Sodium acetate | 1.0 | EDTA-2Na | 1.0 | Thiamin – HCl | 0.05 |
| 2 | K2HPO4 | 0.6 | FeCl3.6H2O | 2.0 | Niacin | 0.05 |
| 3 |
(NH4)2SO4 |
1.0 |
ZnCl2 |
0.1 |
p- aminobenzoic acid |
0.03 |
| 4 | MgSO4.7H2O | 0.2 | MnSO4.H2O | 0.1 | Pyridoxal- HCl | 0.01 |
| 5 | NaCl | 0.2 | H3BO3 | 0.1 | Biotin | 0.005 |
| 6 | CaCl2.2H2O | 0.05 | CoCl2.6H2O | 0.1 | Vitamin B12 | 0.005 |
| 7 | Na2S2O3 | 0.1 | Na2Mo4.2H2O | 0.02 | ||
| 8 | Cao nấm men | 0.1 | CuSO4 | 0.01 | |
| 9 | Hỗn hợp vitamin | 1ml | Na2SeO3 | 0.05 | |
| 10 | Dung dịch vi lượng | 1ml | |||
| 11 | pH | 6.8 – 7 | |||
| ** | Định mức trong 1 lít | Định mức trong 100 mL | Định mức trong 100 mL | ||
* Hàm lượng; ** Dung lượng định mức bằng nước cất
2.1.3. Môi trường nước thải nuôi trồng thủy sản giả định
2.1.3.1. Môi trường khảo sát nhu cầu và khả năng sử dụng NaCl
Môi trường trong đó NaCl được bổ sung để có nồng độ xác định: 0, 5, 10, 15, 20, 25, 30, 35‰ .
2.1.3.2. Môi trường nước thải giả định khảo sát khả năng sử dụng nguồn cacbon
Tạo môi trường nước thải giả định bằng cách bổ sung glucose để có nồng độ hữu cơ lần lượt là: 20, 50, 100, 300, 400mgC/L.
Môi trường đối chứng: môi trường giống với môi trường được bổ sung glucose để có nồng độ hữu cơ tương đương: 20, 50, 100, 300, 400mgC/L nhưng không có VKQH tía chi Rhodobacter.
2.1.3.3. Môi trường nước thải giả định khảo sát khả năng sử dụng sulfide. Môi trường được bổ sung Na2S để có nồng độ S2-: 0.2, 0.5, 1, 2 và
5mgS2-/L.
2.1.4. Thiết bị
– Tủ sấy.
– Máy đo pH.
– Nồi hấp vô trùng.
– Tủ cấy vi sinh (Telstar, Tây Ban Nha).
– Tủ lạnh (Nano Silver, Việt Nam).
– Máy ly tâm Eppendorf (Netheler, Đức).
– Kính hiển quang học.
– Kính hiển vi điện tử.
– Máy quang phổ DR5000.
– Máy sục khí.
2.1.5. Các chỉ tiêu và phương pháp phân tích
Bảng 2.2. Các chỉ tiêu và phương pháp phân tích
| Chỉ tiêu | Phương pháp/Tài liệu sử dụng | Hoá chất/Thiết bị sử dụng |
| pH | pH meter | pH meter HANNA 211 |
| DO | DO meter | Oxymeter WTW 330 |
| COD | Standard Methods 5220 B | Định phân |
| S2- | Standard Methods 3500- D | Chuẩn độ Iot |
| Standard Methods for the Examination of Water and Wastewater (APHA 1995) | ||
2.1.6. Vật liệu để làm mô hình thí nghiệm
Sử dụng bình nhựa 5 lít có nắp đậy, kích thước: đường kính đáy: 14cm, chiều cao: 35.5cm, số lượng: 220 bình.
Hình 2.1. Mô hình bình nhựa trong thí nghiệm.
2.2. PHƯƠNG PHÁP NGHIÊN CỨU
2.2.1. Thí nghiệm 1: Nhân nuôi vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter
Chủng Rhodobacter được nuôi cấy trên môi trường SA, ở điều kiện không sục khí, dưới ánh sáng tự nhiên. Nhiệt độ thích hợp cho sự sinh trưởng của chủng vi khuẩn này là khoảng 28 – 300C, khoảng pH tối ưu là 6.5-7.5.
2.2.1.1. Quan sát hình thái tế bào
Tế bào được nuôi trong môi trường dịch thể ở điều kiện kỵ khí trong ống nghiệm và bình nhựa. Quan sát hình thái tế bào bằng kính hiển vi quang học với vật kính 100X, quan sát và chụp ảnh SEM bằng kính hiển vi điện tử.
2.2.1.2. Xác định khả năng sinh trưởng
Vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter được nuôi cấy trên môi trường SA, ở điều kiện không sục khí dưới ánh sáng tự nhiên. Khả năng tích lũy sinh khối của chủng vi khuẩn quang hợp tía(Rhodobacter) được xác định hàng ngày bằng phương pháp đo độ hấp thụ.
Nguyên tắc: Khi pha lỏng có chứa nhiều phần tử không tan thì sẽ hình thành một hệ huyền phù và có độ đục bởi các phần tử hiện diện trong môi trường lỏng cản ánh sáng, làm phân tán chùm ánh sáng tới. Tế bào vi sinh vật là một thực thể nên khi hiện diện trong môi trường cũng làm môi trường trở nên đục. Giá trị OD (optical density, mật độ quang) càng cao thì độ đục càng cao, chứng tỏ vi khuẩn sinh trưởng càng mạnh. Vì vậy có thể xác định khả năng sinh trưởng của vi khuẩn thông qua đo độ đục bằng máy so màu, phổ hấp thụ ánh sáng cực đại của sắc tố tế bào được xác định khi quét huyền phù tế bào ở dãy bước sóng từ 200 – 1100 nm bằng máy đoquang phổ (DR5000).
Đo độ hấp thụ của dịch nuôi cấy vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter bằng máy quang phổ DR5000 đồng thời đếm mật độ vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter bằng kính hiển vi từ đó xây dựng mối liên hệ giữa mật độ vi khuẩn và độ hấp thụ.
2.2.2. Thí nghiệm 2: Xác định khả năng sinh trưởng của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong các môi trường nước thải nuôi trồng thủy sản giả định có độ mặn khác nhau trong điều kiện không sục khí dưới ánh sáng tự nhiên và che tối.
Thí nghiệm được bố trí hoàn toàn ngẫu nhiên với 16 nghiệm thức (8 nghiệm thức để dưới ánh sáng tự nhiên không sục khí, 8 nghiệm thức che tối không sục khí) và 3 lần lặp lại. Sử dụng 96 bình nhựa có thể tích 5 lít có nắp đậy, cho vào mỗi bình 100ml dịch vi khuẩn của thí nghiệm 1 và môi trường có độ mặn lần lượt 0, 5, 10, 15, 20, 25, 30, 35‰ .
Bố trí thí nghiệm:
Hình 2.2. Sơ đồ bố trí thí nghiệm.
Mật độ vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter được xác định thông qua độ hấp thụ của dịch huyền phù tế bào trên máy quang phổ DR5000.
Độ mặn được chọn để bố trí thí nghiệm 3 tương ứng với mật độ phát triển tối ưu của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter đồng thời phù hợp với nước thải thực tế trong nuôi trồng thủy sản.
2.2.3. Thí nghiệm 3: Xác định khả năng sinh trưởng và hiệu quả xử lý chất hữu cơ của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong điều kiện không sục khí dưới ánh sáng tự nhiên và che tối.
Sau khi xác định độ mặn thích hợp cho vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter tiến hành thí nghiệm xác định khả năng sinh trưởng và hiệu quả xử lý chất hữu cơ.
Thí nghiệm được bố trí hoàn toàn ngẫu nhiên với 10 nghiệm thức (5 nghiệm thức để dưới ánh sáng tự nhiên, 5 nghiệm thức che tối) và 3 lần lặp lại.
Sử dụng 30 bình nhựa có thể tích 5 lít có nắp đậy, cho vào mỗi bình 100ml dịch vi khuẩn của thí nghiệm 1 và môi trường có độ mặn được xác định ở thí nghiệm 2 với hàm lượng chất hữu cơ lần lượt: 20, 50, 100, 300, 400mgC/L.
Thí nghiệm đối chứng: môi trường có độ mặn được xác định ở thí nghiệm 2 với hàm lượng chất hữu cơ lần lượt: 20, 50, 100, 300, 400mgC/L nhưng không bổ sung vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter.
Mật độ của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter được xác định mỗi ngày thông qua độ hấp thụ của dịch huyền phù tế bào trên máy đo quang phổ DR5000.
Hàm lượng hữu cơ được theo dõi mỗi ngày thông qua chỉ tiêu COD.
Môi trường có hàm lượng chất hữu cơ được xác định dựa vào hiệu quả xử lý chất hữa cơ tối ưu của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter.
2.2.4. Thí nghiệm 4: Xác khả năng sinh trưởng và hiệu quả xử lý sulfide của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong các môi trường nước giả định có hàm lượng sulfide khác nhau trong điều kiện không sục khí dưới ánh sáng tự nhiên và che tối.
Nghiên cứu trên môi trường có độ mặn và hàm lượng chất hữu cơ thích hợp được chọn từ kết quả của thí nghiệm 2 và 3 để thiết lập nghiên cứu khả năng xử lý sulfide.
Thí nghiệm được bố trí hoàn toàn ngẫu nhiên với 10 nghiệm thức (5 nghiệm thức để dưới ánh sáng tự nhiên, 5 nghiệm thức che tối) và 3 lần lặp lại.
Sử dụng 30 bình nhựa có thể tích 5 lít có nắp đậy, cho vào mỗi bình 100ml dịch vi khuẩn của thí nghiệm 1, môi trường có độ mặn được xác định ở thí nghiệm 2 và hàm lượng chất hữu cơ được xác định ở thí nghiệm 3 với hàm lượng S2- lần lượt là: 0.2, 0.5 1, 2, 5mgS2-/L.
Mật độ của VKQH tía không lưu huỳnh chi Rhdobacter được xác định thông qua xác định độ hấp thụ của dịch huyền phù tế bào trên máy đo quang phổ DR5000. Khả năng khử sulfide của chúng được xác định thông qua hàm lượng sulfide còn lại bằng phương pháp chuẩn độ được phân tích hằng ngày.
2.2.5. Thí nghiệm 5: Xác định khả năng sinh trưởng của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong các môi trường nước giả định có độ mặn khác nhau trong điều kiện có sục khí dưới ánh sáng tự nhiên và che tối.
Thí nghiệm được tiến hành sục khí và bố trí tương tự thí nghiệm 2 (phần không sục khí).
2.2.6. Thí nghiệm 6: Xác định khả năng sinh trưởng và hiệu quả xử lý chất hữu cơ của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong điều kiện có sục khí dưới ánh sáng tự nhiên và che tối.
Thí nghiệm được tiến hành sục khí và bố trí tương tự thí nghiệm 3 (phần không sục khí).
2.2.7. Thí nghiệm 7: Xác khả năng sinh trưởng và hiệu quả xử lý sulfide của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong các môi trường nước giả định có hàm lượng sulfide khác nhau trong điều kiện có sục khí dưới ánh sáng tự nhiên và che tối.
Thí nghiệm được tiến hành sục khí và bố trí tương tự thí nghiệm 4 (phần không sục khí).
CHƯƠNG 3. KẾT QUẢ VÀ THẢO LUẬN
3.1. KẾT QUẢ NHÂN NUÔI VKQH TÍA KHÔNG LƯU HUỲNH CHI RHODOBACTER
3.2. KHẢ NĂNG SINH TRƯỞNG CỦA VKQH TÍA KHÔNG LƯU HUỲNH CHI RHODOBACTER Ở CÁC ĐỘ MẶN KHÁC NHAU TRONG ĐIỀU KIỆN KHÔNG SỤC KHÍ
3.3. KHẢ NĂNG SINH TRƯỞNG VÀ XỬ LÝ CHẤT HỮU CƠ CỦA VKQH TÍA KHÔNG LƯU HUỲNH CHI RHODOBACTER TRONG ĐIỀU KIỆN KHÔNG SỤC KHÍ
3.4. KHẢ NĂNG SINH TRƯỞNG VÀ KHỬ SULFIDE CỦA VKQH TÍA KHÔNG LƯU HUỲNH CHI RHODOBACTER TRONG ĐIỀU KIỆN KHÔNG SỤC KHÍ
3.5. KHẢ NĂNG SINH TRƯỞNG CỦA VKQH TÍA KHÔNG LƯU HUỲNH CHI RHODOBACTER Ở CÁC ĐỘ MẶN KHÁC NHAU TRONG ĐIỀU KIỆN CÓ SỤC KHÍ
3.6. KHẢ NĂNG SINH TRƯỞNG VÀ XỬ LÝ CHẤT HỮU CƠ CỦA VKQH TÍA KHÔNG LƯU HUỲNH CHI RHODOBACTER TRONG ĐIỀU KIỆN CÓ SỤC KHÍ
3.7. KHẢ NĂNG SINH TRƯỞNG VÀ KHỬ SULFIDE CỦA VKQH TÍA KHÔNG LƯU HUỲNH CHI RHODOBACTER TRONG ĐIỀU KIỆN CÓ SỤC KHÍ
CHƯƠNG 3. KẾT QUẢ VÀ THẢO LUẬN
3.1. KẾT QUẢ NHÂN NUÔI VKQH TÍA KHÔNG LƯU HUỲNH CHI RHODOBACTER
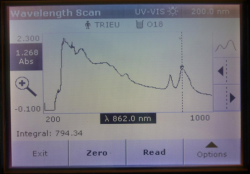
Vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter được nuôi bằng môi trường SA trong điều kiện không sục khí dưới ánh sáng tự nhiên. Sau 14 ngày sự tăng trưởng sinh khối của VKQH tía không lưu huỳnh chi Rhodobacter với màu sắc đặc trưng từ nâu vàng sang đỏ tía. Quét phổ hấp thụ dịch huyền phù tế bào VKQH hợp tía không lưu huỳnh chi Rhodobacter xác định được độ hấp thụ cực đại 1.268Abs tại bước sóng 862nm.
Hình 3.1. Phổ hấp thụ của dịch tế bào vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter.
Hình thái tế bào
Hình 3.2. Hình chụp SEM tế bào vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter.
Hình 3.3. Hình chụp SEM tế bào vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong môi trường SA.
Hình 3.4. Kết quả nhân nuôi vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter tại phòng thí nghiệm khoa Khoa học Môi trường trường Đại học Sài Gòn.
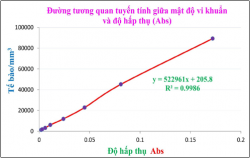
3.1.1. Mối liên hệ giữa độ hấp thụ và mật độ vi khuẩn
Hình 3.5. Đường tương quan tuyến tính giữa mật độ VK và độ hấp thụ (Abs).
Mật độ vi khuẩn và độ hấp thụ có mối quan hệ tuyến tính thuận.
3.1.2. DIỄN BIẾN QUÁ TRÌNH SINH TRƯỞNG PHÁT TRIỂN CỦA VI KHUẨN QUANG HỢP TÍA KHÔNG LƯU HUỲNH CHI RHODOBACTER TRONG MÔI TRƯỜNG SA
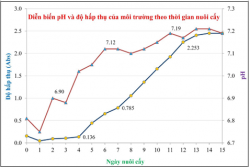
Mức độ tích lũy sinh khối của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter sau 14 ngày cho thấy chúng có khả năng sinh trưởng rất tốt trong môi trường SA, dịch huyền phù chuyển dần từ nâu vàng sang màu đỏ tía với mật độ vi khuẩn ngày 0 là 82×109 tế bào/L(∆OD862: 0.156Abs) và ngày 14 là 1.3×1012 tế bào/L((∆OD862: 2.45Abs), pH môi trường dao động từ 6.75-7.19, oxy hòa tan (DO) dao động từ 0-2mg/L.
3.2. KHẢ NĂNG SINH TRƯỞNG CỦA VKQH TÍA KHÔNG LƯU HUỲNH CHI RHODOBACTER Ở CÁC ĐỘ MẶN 0, 5, 10, 15, 20, 25, 30, 35‰ TRONG ĐIỀU KIỆN KHÔNG SỤC KHÍ DƯỚI ÁNH SÁNG TỰ NHIÊN VÀ CHE TỐI
Hình 3.6. Khả năng sinh trưởng của VKQH tía chi Rhodobacter trong 14 ngày nhân nuôi.
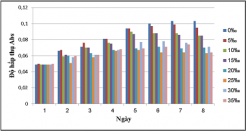
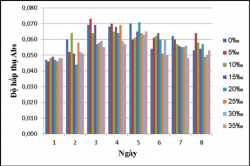
Tiến hành nuôi cấy vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong các môi trường nước thải giả định có nồng độ muối thay đổi: 0, 5, 10, 15, 20, 25, 30, 35‰ tại điều kiện không sục khí dưới ánh sáng tự nhiên và che tối. Khả năng sinh trưởng (OD862) của chủng Rhodobacter được được theo dõi mỗi ngày.
Kết quả khảo sát khả năng sinh trưởng của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter ở các độ mặn 0, 5, 10, 15, 20, 25, 30, 35‰.
Hình 3.7. Khả năng sinh trưởng vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong đó NaCl được bổ sung để có nồng độ xác định: 0, 5, 10, 15, 20, 25, 30, 35‰, nhiệt độ 28 – 300C, không sục khí dưới ánh sáng tự nhiên.
Hình 3.8. Khả năng sinh trưởng vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong đó NaCl được bổ sung để có nồng độ xác định: 0, 5, 10, 15, 20, 25, 30, 35‰, nhiệt độ 28 – 300C, không sục khí che tối.
Kết quả cho thấy vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter thích nghi với hầu hết các độ mặn, chúng có thể sinh trưởng ở tất cả các độ mặn được khảo sát, trong đó các độ mặn 0, 5, 10, 15, 20‰ thì vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter sinh trưởng tốt nhất, khả năng sinh trưởng của chủng không tăng theo độ mặn vì vậy chủng có khả năng chịu mặn cao không có nhu cầu NaCl.
Ở điều kiện không sục khí dưới ánh sáng tự nhiên thì khả năng sinh trưởng của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter cao hơn so với trong điều kiện không sục khí che tối.
Khả năng chịu mặn cao của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter có ý nghĩa rất quan trọng trong việc ứng dụng chúng để xử lý nước thải nuôi trồng thủy sản hay nhiều mục đích khác.
3.3. KHẢ NĂNG SINH TRƯỞNG VÀ XỬ LÝ CHẤT HỮU CƠ CỦA VI KHUẨN QUANG HỢP TÍA CHI RHODOBACTER TRONG ĐIỀU KIỆN KHÔNG SỤC KHÍ DƯỚI ÁNH SÁNG TỰ NHIÊN
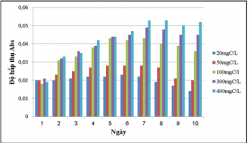
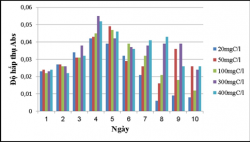
Để đánh giá khả năng sinh trưởng và xử lý chất hữu cơ của chủng VKQH tía chi Rhodobacter trong môi trường nước thải giả định có hàm lượng cacbon 20, 50, 100, 300, 400mgC/L, tiến hành nuôi các chủng trong môi trường nước thải giả định có bổ sung hàm lượng cacbon 20, 50, 100, 300, 400mgC/L. Thí nghiệm được tiến hành trong điều kiện không sục khí dưới ánh sáng tự nhiên và che tối. Sự tích lũy sinh khối và xử lý chất hữu cơ của chủng được theo dõi trong 10 ngày.
Kết quả khảo sát khả năng sinh trưởng của VKQH tía với các hàm lượng cacbon 20, 50, 100, 300, 400mgC/L:
Hình 3.9. Khả năng sinh trưởng của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter với các hàm lượng cacbon 20, 50, 100, 300, 400mgC/L , nhiệt độ 28 – 300C, không sục khí dưới ánh sáng tự nhiên.
Hình 3.10. Khả năng sinh trưởng của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter với các hàm lượng cacbon 20, 50, 100, 300, 400mgC/L , nhiệt độ 28 – 300C, không sục khí che tối.
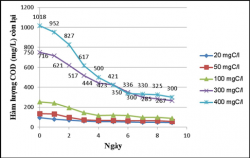
Theo dõi mức độ tích lũy sinh khối của các chủng nuôi cấy sau 10 ngày cho thấy chủng vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter đều sinh trưởng ở tất cả các hàm lượng cacbon 20, 50, 100, 300, 400mgC/L, trong điều kiện không sục khí dưới ánh sáng tự nhiên ở hàm lượng 100, 300, 400mgC/L thì chủng sinh trưởng tốt nhất, hàm lượng 20, 50mgC/L chủng sinh trưởng yếu, còn trong điều kiện không sục khí che tối ở hàm lượng 300, 400mgC/L chủng sinh trưởng tốt hơn hàm lượng 20, 50, 100mgC/L.
Ở điều kiện không sục khí dưới ánh sáng tự nhiên thì chủng sinh trưởng tích lũy sinh khối cao hơn trong điều kiện không sục khí che tối.
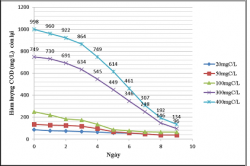
Kết quả khảo sát khả năng xử lý của VKQH tía với các hàm lượng cacbon 20, 50, 100, 300, 400mgC/L.
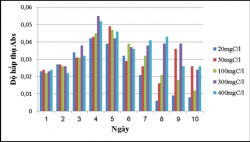
Hình 3.11. Khả năng xử lý của VKQH tía không lưu huỳnh chi Rhodobacter với các hàm lượng hữu cơ 20, 50, 100, 300, 400mgC/L, ở điều kiện không sục khí dưới ánh sáng tự nhiên.
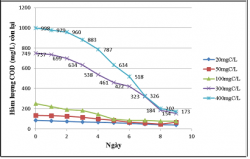
Hình 3.12. Khả năng xử lý của VKQH tía không lưu huỳnh chi Rhodobacter với hàm lượng HC 20, 50, 100, 300,
Bảng 3.1. Biến đổi hàm lượng chất HC trong các bình TN và hiệu quả xử lý trong điều kiện không sục khí dưới ánh sáng tự nhiên sau 10 ngày thử nghiệm
| Bình có vi khuẩn | Bình đối chứng | |||||
| Hàm lượng cacbon bổ sung | Hàm lượng COD
ngày 0 |
Hàm lượng COD
ngày 10 |
Hiệu suất loại bỏ cacbon(%) | Hàm lượng COD
ngày 0 |
Hàm lượng COD
ngày 10 |
Hiệu suất loại bỏ cacbon(%) |
| 20mgC/L | 86 | 36 | 58 | 86 | 66 | 23 |
| 50mgC/L | 134 | 38 | 72 | 134 | 112 | 16 |
| 100mgC/L | 250 | 63 | 75 | 250 | 230 | 8 |
| 300mgC/L | 749 | 96 | 87 | 749 | 725 | 3 |
| 400mgC/L | 998 | 134 | 87 | 998 | 970 | 3 |
Bảng 3.2. Biến đổi hàm lượng chất HC trong các bình thí nghiệm và hiệu quả xử lý trong điều kiện không sục khí che tối sau 10 ngày thử nghiệm
| Bình có vi khuẩn | Bình đối chứng | |||||
| Hàm lượng cacbon bổ sung | Hàm lượng COD
ngày 0 |
Hàm lượng COD
ngày 10 |
Hiệu suất loại bỏ cacbon(%) | Hàm lượng COD
ngày 0 |
Hàm lượng COD
ngày 10 |
Hiệu suất loại bỏ cacbon(%) |
| 20mgC/L | 86 | 40 | 58 | 86 | 65 | 24 |
| 50mgC/L | 134 | 67 | 50 | 134 | 110 | 18 |
| 100mgC/L | 250 | 77 | 69 | 250 | 230 | 8 |
| 300mgC/L | 749 | 154 | 79 | 749 | 722 | 4 |
| 400mgC/L | 998 | 173 | 83 | 998 | 975 | 2 |
Nhận xét:
Kết quả cho thấy vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter này có hiệu xuất xử lý chất hữu cơ cao, ở các hàm lượng hữu cơ 20, 50, 100, 300, 400mgC/L được khảo sát thì hàm lượng hữu cơ càng cao thì chủng càng sinh trưởng và có hiệu suất xử lý càng cao, ở hàm lượng 400mgC/L hiệu suất xử lý ở cả trong điều kiện dưới ánh sáng tự nhiên lẫn che tối đều trên 80%, ở hàm lượng chất hữu cơ 20 và 50mgC/L thì chủng sinh trưởng yếu và hiệu suất xử lý thấp.
Ở điều kiện không sục khí dưới ánh sáng tự nhiên thì chủng sinh trưởng tốt hơn và có hiệu suất xử lý cao hơn so với trong điều kiện không sục khí che tối.
Ở các bình đối chứng thì hàm lượng hữu cơ gần như không thay đổi nhiều so với ban đầu. Vì vậy sự giảm về hàm lượng hữu cơ trong các môi trường có chứa vi khuẩn là do vi khuẩn sử dụng chất hữu cơ làm cơ chất để sinh trưởng hay nói cách khác chúng có khả năng xử lý chất hữu cơ của nước thải, vậy chúng có khả năng sử dụng glucose làm nguồn cacbon cho sinh trưởng.
Kết quả này có ý nghĩa rất quan trọng để có thể ứng dụng chủng vi khuẩn này trong xử lý nước nuôi trồng thủy sản cũng như nhiều loại nước thải khác.
3.4. KHẢ NĂNG SINH TRƯỞNG VÀ KHỬ SULFIDE CỦA VK QUANG HỢP TÍA KHÔNG LƯU HUỲNH TRONG ĐIỀU KIỆN KHÔNG SỤC KHÍ DƯỚI ÁNH SÁNG TỰ NHIÊN VÀ CHE TỐI
Để đánh giá khả năng sinh trưởng và khử sulfide của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong môi trường nước giả định chứa sulfide, tiến
hành nuôi các chủng trong môi trường nước giả định có bổ sung Na2S với hàm lượng: 0.2, 0.5, 1, 2, 5mgS2-/L.
Thí nghiệm được tiến hành trong điều kiện không sục khí dưới ánh sáng tự nhiên và không sục khí che tối. Sự tích lũy sinh khối và khử sulfide của chủng sau 1 tuần nuôi cấy được trình bày ở các bảng sau :
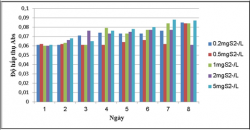
Kết quả khảo sát khả năng sinh trưởng của VKQH tía không lưu huỳnh chi Rhodobacter với các hàm lượng Na2S 0.2, 0.5, 1, 2, 5mg/L.
Hình 3.13. Khả năng sinh trưởng của VKQH tía không lưu huỳnh chi Rhodobacter với các hàm lượng S2- 0.2, 0.5, 1, 2, 5mg/L , nhiệt độ 28 – 300C, không sục khí dưới ánh sáng tự nhiên.
Hình 3.14. Khả năng sinh trưởng của VKQH tía không lưu huỳnh chi Rhodobacter với các hàm lượng S2- 0.2, 0.5, 1, 2, 5mg/L , nhiệt độ 28 – 300C, không sục khí che tối.
Nhận xét:
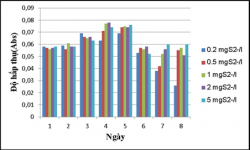
Kết quả cho thấy: VKQH tía không lưu huỳnh chi Rhodobacter sinh trưởng tốt và đều ở tất cả các hàm lượng S2-0.2, 0.5, 1, 2, 5mg/L, vậy chủng này có thể sinh trưởng tốt trong môi trường nước thải giả định có mặt sulfide và các hàm lượng S2- này vẫn ở trong khoảng thích nghi của chủng chưa vượt quá hàm lượng sulfide có thể gây ức chế đến sinh trưởng của VKQH tía chi Rhodobacter.
Trong điều kiện không sục khí dưới ánh sáng tự nhiên thì chúng sinh trưởng tốt hơn so với trong điều kiện không sục khí che tối.
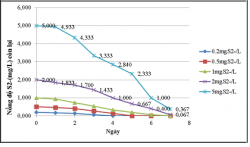
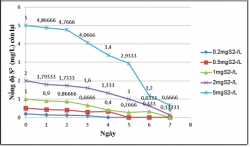
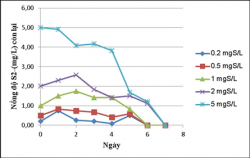
Kết quả khử sulfide của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter với hàm lượng S2- 0.2, 0.5, 1, 2, 5mg/L.
Hình 3.15. Khả năng khử sulfide của VKQH tía không lưu huỳnh chi Rhodobacter hàm lượng S2-0.2, 0.5, 1, 2, 5mg/L, ở điều kiện không sục khí, ánh sáng tự nhiên.
Hình 3.16. Khả năng khử sulfide của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter với hàm lượng S2-0.2, 0.5, 1, 2, 5mg/L, ở điều kiện không sục khí che tối.
Bảng 3.3. Khả năng sử dụng sulfide của các vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong điều kiện không sục khí dưới ánh sáng tự nhiên sau 7 ngày.
| Bình có vi khuẩn | Bình đối chứng | ||||
| Hàm lượng sulfide ban đầu (mg/L) | Hàm lượng sulfide còn lại (mg/L) | Hiệu suất loại bỏ sulfide (%) | Hàm lượng sulfide ban đầu (mg/L) | Hàm lượng sulfide còn lại (mg/L) | Hiệu suất loại bỏ sulfide (%) |
| 0.2 | 0.000 | 100 | 0.2 | 0.2 | 0 |
| 0.5 | 0.000 | 100 | 0.5 | 0.5 | 0 |
| 1 | 0.000 | 100 | 1 | 1 | 0 |
| 2 | 0.067 | 96.65 | 2 | 1.98 | 1 |
| 5 | 0.367 | 93 | 5 | 5 | 0 |
Bảng 3.4. Khả năng sử dụng sulfide của các vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong điều kiện không sục khí che tối sau 7 ngày.
| Bình có vi khuẩn | Bình đối chứng | ||||
| Hàm lượng sulfide ban đầu (mg/L) | Hàm lượng sulfide còn lại (mg/L) | Hiệu suất loại bỏ sulfide (%) | Hàm lượng sulfide ban đầu (mg/L) | Hàm lượng sulfide còn lại (mg/L) | Hiệu suất loại bỏ sulfide (%) |
| 0.2 | 0.000 | 100 | 0.2 | 0.2 | 0 |
| 0.5 | 0.000 | 100 | 0.5 | 0.5 | 0 |
| 1 | 0.000 | 100 | 1 | 1 | 0 |
| 2 | 0.133 | 93.35 | 2 | 2 | 0 |
| 5 | 0.667 | 86.7 | 5 | 5 | 0 |
Kết quả cho thấy VKQH tía không lưu huỳnh chi Rhodobacter có khả năng khử sulfide rất cao ở hàm lượng S2-0.2, 0.5, 1, 2, 5mg/L, sulfide gần như bị loại bỏ hoàn toàn, ở các hàm lượng 0.2, 0.5, 1mg S2-/L sulfide đã bị loại bỏ hoàn toàn.
Khả năng khử sulfide ở điều kiện không sục khí dưới ánh sáng tự nhiên cao hơn ở điều kiện không sục khí che tối.
Khả năng này là một trong những ưu thế của VKQH tía không lưu huỳnh chi Rhodobacter so với các nhóm vi khuẩn khác khi tham gia xử lý nước thải và nó có ý nghĩa rất quan trọng trong việc ứng dụng VKQH tía không lưu huỳnh chi Rhodobacter vào trong xử lý nước thải.
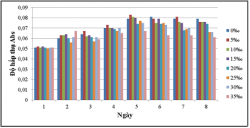
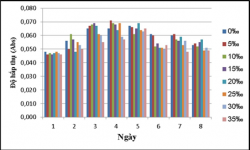
3.5. KHẢ NĂNG SINH TRƯỞNG CỦA VKQH TÍA KHÔNG LƯU HUỲNH CHI RHODOBACTER Ở CÁC ĐỘ MẶN O, 5, 10, 15, 20, 25, 30, 35‰ TRONG ĐIỀU KIỆN SỤC KHÍ DƯỚI ÁNH SÁNG TỰ NHIÊN VÀ CHE TỐI
Kết quả khảo sát khả năng sinh trưởng của vi khuẩn quang hợp tía không
lưu huỳnh chi Rhodobacter ở các độ mặn 0, 5, 10, 15, 20, 25, 30, 35‰.
Hình 3.17. Khả năng sinh trưởng VKQH tía không lưu huỳnh chi Rhodobacter trong đó NaCl được bổ sung để có nồng độ xác định: 0, 5, 10, 15, 20, 25, 30, 35‰,
nhiệt độ 28 – 310C, sục khí dưới ánh sáng tự nhiên.
Hình 3.18. Khả năng sinh trưởng vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong đó NaCl được bổ sung để có nồng độ xác định: 0, 5, 10, 15, 20, 25, 30, 35‰, nhiệt độ 28 – 310C, sục khí che tối.
Nhận xét:
Kết quả cho thấy vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter thích nghi với hầu hết các độ mặn, chúng có thể sinh trưởng ở tất cả các độ mặn được khảo sát, trong đó các độ mặn 0 – 20‰ thì vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter sinh trưởng tốt hơn và ổn định hơn.
Ở điều kiện sục khí dưới ánh sáng tự nhiên thì khả năng sinh trưởng của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter cao hơn so với trong điều kiện sục khí che tối.
Để ứng dụng vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter vào các mục đích trong nuôi trồng thủy sản và trong đề tài này sẽ khảo sát khả năng sinh
trưởng và xử lý chất hữu cơ, hàm lượng sulfide thì độ mặn 15‰ được lựa chọn để tiến hành thử nghiệm.
Như vậy, trong các điều kiện khảo sát độ mặn ta nhận thấy chủng vi khuẩn phát triển mạnh nhất khi không sục khí dưới ánh sáng tự nhiên.
3.6. KHẢ NĂNG SINH TRƯỞNG VÀ XỬ LÝ CHẤT HỮU CƠ CỦA VKQH TÍA KHÔNG LƯU HUỲNH CHI RHODOBACTER TRONG ĐIỀU KIỆN SỤC KHÍ DƯỚI ÁNH SÁNG TỰ NHIÊN VÀ CHE TỐI
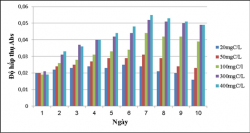
Thí nghiệm được tiến hành trong điều kiện sục khí dưới ánh sáng tự nhiên và sục khí che tối. Lượng Cacbon được bổ sung bằng đường Saccarose với các giá trị nồng độ chất hữu cơ khác nhau.
Kết quả khảo sát khả năng sinh trưởng của VKQH tía với các hàm lượng cacbon 20, 50, 100, 300, 400mgC/L:
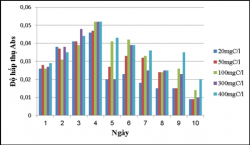
Hình 3.19. Khả năng sinh trưởng của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter với các hàm lượng cacbon 20, 50, 100, 300, 400mgC/L , nhiệt độ 28 – 300C, sục khí dưới ánh sáng tự nhiên.
Hình 3.20. Khả năng sinh trưởng của VKQH tía không lưu huỳnh chi Rhodobacter với các hàm lượng HC 20, 50, 100, 300, 400mgC/L ( 28 – 300C), sục khí che tối.
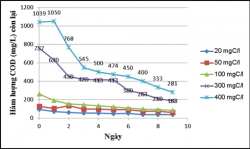
Hình 3.21. Khả năng xử lý của VKQH tía không lưu huỳnh chi Rhodobacter với hàm lượng hữu cơ 20, 50, 100, 400, 500mgC/L, ở điều kiện sục khí dưới ánh sáng tự nhiên.
Hình 3.22. Khả năng xử lý của VKQH tía không lưu huỳnh chi Rhodobacter với hàm lượng hữu cơ 20, 50, 100, 300, 400mgC/L, ở điều kiện sục khí che tối.
Bảng 3.5. Biến đổi hàm lượng chất hữu cơ trong các bình thí nghiệm và hiệu quả xử lý trong điều kiện sục khí dưới ánh sáng tự nhiên sau 10 ngày tiến hành thử nghiệm
| Bình có vi khuẩn | Bình đối chứng | |||||
| Hàm lượng cacbon bổ sung | Hàm lượng COD
ngày 0 |
Hàm lượng COD
ngày 10 |
Hiệu suất loại bỏ cacbon(%) | Hàm lượng COD
ngày 0 |
Hàm lượng COD
ngày 10 |
Hiệu suất loại bỏ cacbon(%) |
| 20mgC/L | 92 | 36 | 61 | 92 | 64 | 30 |
| 50mgC/L | 128 | 62 | 51 | 128 | 97 | 24 |
| 100mgC/L | 259 | 84 | 68 | 259 | 210 | 19 |
| 300mgC/L | 757 | 188 | 75 | 757 | 651 | 14 |
| 400mgC/L | 1039 | 281 | 73 | 1039 | 925 | 11 |
Bảng 3.6. Biến đổi hàm lượng chất hữu cơ trong các bình thí nghiệm và hiệu quả xử lý trong điều kiện sục khí che tối sau 10 ngày thử nghiệm
| Bình có vi khuẩn | Bình đối chứng | |||||
| Hàm lượng cacbon bổ sung | Hàm lượng COD
ngày 0 |
Hàm lượng COD
ngày 10 |
Hiệu suất loại bỏ cacbon(%) | Hàm lượng COD
ngày 0 |
Hàm lượng COD
ngày 10 |
Hiệu suất loại bỏ cacbon(%) |
| 20mgC/L | 96 | 46 | 52 | 96 | 72 | 25 |
| 50mgC/L | 136 | 59 | 57 | 136 | 107 | 21 |
| 100mgC/L | 255 | 89 | 65 | 255 | 250 | 17 |
| 300mgC/L | 750 | 267 | 64 | 750 | 653 | 13 |
| 400mgC/L | 1018 | 300 | 71 | 1018 | 926 | 9 |
Nhận xét:
Theo kết quả: Chủng VKQH tía không lưu huỳnh chi Rhodobacter đều sinh trưởng ở các hàm lượng cacbon 20, 50, 100, 300, 400mgC/L, trong đó ở hàm lượng 50, 100, 300, 400mgC/L thì chủng sinh trưởng tốt nhất (Hình 3.20).
Kết quả cho thấy vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter này có hiệu xuất xử lý chất hữu cơ tương đối cao, ở các hàm lượng hữu cơ 20, 50, 100, 300, 400mgC/L được khảo sát thì hàm lượng hữu cơ càng cao thì chủng càng sinh trưởng và có hiệu suất xử lý càng cao, ở hàm lượng 100; 300; 400mgC/L hiệu suất xử lý ở cả trong điều kiện sục khí dưới ánh sáng tự nhiên lẫn che tối đều khá cao từ 60 – 70%, ở hàm lượng chất hữu cơ 20 và 50mgC/L thì chủng sinh trưởng yếu và hiệu suất xử lý thấp hơn.
Ở điều kiện sục khí dưới ánh sáng tự nhiên thì chủng sinh trưởng tốt hơn và có hiệu suất xử lý cao hơn so với trong điều kiện sục khí che tối.
Như vậy, vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter cò khả năng loại bỏ chất hữu cơ trong môi trường kỵ khí và hiếu khí đều rất hiệu quả, trong đó ở điều kiện không sục khí dưới ánh sáng tự nhiên thì chủng sinh trưởng và có hiệu suất xử lý tốt nhất.
3.7. KHẢ NĂNG SINH TRƯỞNG VÀ KHỬ SULFIDE CỦA VKQH TÍA KHÔNG LƯU HUỲNH CHI RHODOBACTER TRONG ĐIỀU KIỆN SỤC KHÍ DƯỚI ÁNH SÁNG TỰ NHIÊN VÀ CHE TỐI
Thí nghiệm được tiến hành trong điều kiện sục khí dưới ánh sáng tự nhiên và sục khí che tối. Sự tích lũy sinh khối và khử sulfide của chủng sau 1 tuần nuôi cấy được trình bày ở các bảng sau :
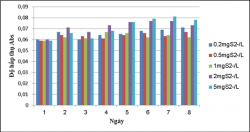
Kết quả khảo sát khả năng sinh trưởng của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter với các hàm lượng Na2S 0.2, 0.5, 1, 2, 5mg/L.
Hình 3.23. Khả năng sinh trưởng của VKQH tía không lưu huỳnh chi Rhodobacter với các hàm lượng S2- 0.2, 0.5, 1, 2, 5mg/L , nhiệt độ 27 – 310C, sục khí sáng.
Hình 3.24. Khả năng sinh trưởng của VKQH tía không lưu huỳnh chi Rhodobacter với các hàm lượng S2- 0.2, 0.5, 1, 2, 5mg/L , nhiệt độ 28 – 300C, sục khí che tối.
Nhận xét:
Qua kết quả cho thấy vi khuẩn tía không lưu huỳnh chi Rhodobacter sinh trưởng tốt và đều ở tất cả các hàm lượng S2- 0.2, 0.5, 1, 2, 5mg/L vậy chủng này có thể sinh trưởng tốt trong môi trường nước thải giả định có mặt sulfide và các hàm lượng S2- này vẫn ở trong khoảng thích nghi của chủng chưa vượt quá hàm lượng sulfide có thể gây ức chế đến sinh trưởng của VKQH tía chi Rhodobacter.
Trong đó ở điều kiện sục khí dưới ánh sáng tự nhiên thì chủng sinh trưởng và phát triển đồng đều ít biến động hơn so với trong điều kiện sục khí che tối.
Dựa vào hình 3.13, 3.14, 3.23, 3.24 ta nhận thấy vi khuẩn quang hợp tía chi Rhodobacter có khuynh hướng phát triển tốt hơn trong môi trường nước có S2- dưới điều kiện không sục khí chiếu sáng tự nhiên.
Kết quả khử sulfide của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter với hàm lượng S2- 0.2, 0.5, 1, 2, 5mg/L
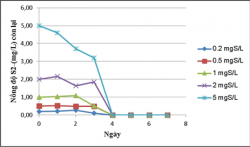
Hình 3.25. Khả năng khử sulfide của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter với hàm lượng S2-0.2, 0.5, 1, 2, 5mg/L, ở điều kiện có sục khí dưới ánh sáng tự nhiên.
Hình 3.26. Khả năng khử sulfide của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter với hàm lượng S2-0.2, 0.5, 1, 2, 5mg/L, ở điều kiện không sục khí che tối.
Bảng 3.7. Khả năng sử dụng sulfide của các VKQH tía không lưu huỳnh chi Rhodobacter trong điều kiện có sục khí dưới ánh sáng tự nhiên sau 7 ngày
Bảng 3.8. Khả năng sử dụng sulfide của các vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter trong điều kiện có sục khí che tối sau 7 ngày.
| Bình có vi khuẩn | Bình đối chứng | ||||||
| Hàm lượng sulfide ban đầu (mg/L) | Hàm lượng sulfide ngày thứ 4 (mg/L) | Hàm lượng sulfide còn lại (mg/L) | Hiệu suất loại bỏ sulfide (%) | Hàm lượng sulfide ban đầu (mg/L) | Hàm lượng sulfide ngày thứ 4 (mg/L) | Hàm lượng sulfide còn lại (mg/L) | Hiệu suất loại bỏ sulfide (%) |
| 0.2 | 0.08 | 0.00 | 100 | 0.2 | 0.15 | 0.08 | 58 |
| 0.5 | 0.42 | 0.00 | 100 | 0.5 | 0.25 | 0.23 | 55 |
| 1 | 1.42 | 0.00 | 100 | 1 | 0.76 | 0.50 | 50 |
| 2 | 1.42 | 0.00 | 100 | 2 | 1.22 | 0.92 | 54 |
| 5 | 5.83 | 0.00 | 100 | 5 | 4.54 | 2.40 | 52 |
Trong điều kiện sục khí dưới ánh sáng tự nhiên và che tối vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter có khả năng khử sulfide gần như hoàn toàn sau 4 ngày (chiếu sáng tự nhiên) và sau 7 ngày ( che tối) tại các hàm lượng S2-0.2, 0.5, 1, 2, 5mg/L.
Việc loại bỏ S2- đạt hiệu quả gần như tuyệt đối trong trường hợp sục khí của chủng vi khuẩn này một phần (50%) là do SULFIDE thoát vào môi trường do sự khuấy trộn.
KẾT LUẬN – KIẾN NGHỊ
I. KẾT LUẬN
II. KIẾN NGHỊ
54
KẾT LUẬN VÀ KIẾN NGHỊ
I. KẾT LUẬN
Chủng vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter sinh trưởng tốt trên môi trường SA ở nhiệt độ từ 28 – 300C, dịch huyền phù có màu đỏ tía, phổ hấp thụ dịch huyền phù tế bào cực đại của chủng tại 862nm đặc trưng cho bacteriochlorophyl a, pH tối ưu ở khoảng trung tính 6.5-7.5, oxy hòa tan (DO) dao động từ 0-2mgO2/L đối với môi trường kỵ khí và hiếu khí là 5- 7mgO2/L.
Chủng vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter sinh trưởng ở tất cả các độ mặn 0, 5, 10, 15, 20, 25, 30, 35‰, trong đó ở các độ mặn 0, 5, 10, 15, 20‰ chủng sinh trưởng cao hơn các độ mặn còn lại, ở điều kiện không sục khí dưới ánh sáng thì sinh trưởng tốt hơn ở điều kiện không sục khí che tối. Và ở điều kiện sục khí có ánh sáng chủng cũng sinh trưởng tốt hơn ở điều kiện có sục khí che tối.
Khả năng sinh trưởng và xử lý chất hữu cơ của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter:
Chủng vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter đều sinh trưởng ở tất cả các hàm lượng cacbon 20, 50, 100, 300, 400mgC/L, trong điều kiện không sục khí và có sục khí dưới ánh sáng tự nhiên ở hàm lượng 100, 300, 400mgC/L thì chủng sinh trưởng tốt nhất, hàm lượng 20, 50mgC/L chủng sinh trưởng yếu, còn trong điều kiện không sục khí che tối ở hàm lượng 300, 400mgC/L chủng sinh trưởng tốt hơn hàm lượng 20, 50, 100mgC/L.
Ở điều kiện không sục khí hoặc sục khí dưới ánh sáng thì chủng sinh trưởng tích lũy sinh khối cao hơn trong điều kiện không sục khí và có sục khí che tối.
Chủng vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter này có hiệu suất xử lý chất hữu cơ cao ở các hàm lượng hữu cơ 20, 50, 100, 300,
400mgC/L được khảo sát, hàm lượng hữu cơ càng cao thì chủng càng sinh trưởng và có hiệu suất xử lý càng cao.
Ở điều kiện không sục khí dưới ánh sáng tự nhiên thì chủng sinh trưởng tốt hơn và có hiệu suất xử lý cao hơn so với trong điều kiện không sục khí che tối.
Khả năng sinh trưởng và khử sulfide của vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter:
Chủng vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter có khả năng sinh trưởng tốt và hoạt tính khử sulfide cao.
Ở điều kiện không sục khí dưới ánh sáng thì chủng sinh trưởng tốt hơn và có hiệu suất xử lý cao hơn so với trong điều kiện không sục khí che tối.
Ở điều kiện sục khí (DO = 5-7mgO2/L) có oxy S2- trong nước chuyển
sang dạng SO4 không gây độc cho môi trường hay thủy sinh vật trong nước.
Ở điều kiện không sục khí và có sục khí dưới ánh sáng tự nhiên thì vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter sinh trưởng tốt hơn trong điều kiện không sục khí và có sục khí che tối vì vậy chủng này thuộc chủng sinh trưởng quang dị dưỡng.
Vi khuẩn quang hợp tía không lưu huỳnh chi Rhodobacter rất có tiềm năng trong việc sử dụng chúng để xử lý nước thải ô nhiễm hữu cơ và ô nhiễm SULFIDE đặc biệt là nước thải nuôi trồng thủy sản vì chúng có thể chịu độ mặn cao và còn có thể làm thức ăn cho thủy sản.
II. KIẾN NGHỊ
Hướng nghiên cứu tiếp theo:
Nghiên cứu khả năng sử dụng tối ưu nguồn nitrogen và photpho trong nước thải và tối ưu hóa môi trường nhân nuôi chủng vi khuẩn Rhodobacter Nghiên cứu thu hồi sinh khối và sản xuất chế phẩm sinh học từ chủng VKQH tía chi Rhodobacter.
Nghiên cứu khả năng sử dụng tối ưu nguồn nitrogen và photpho trong nước thải và tối ưu hóa môi trường nhân nuôi chủng vi khuẩn Rhodobacter.
Nghiên cứu thu hồi sinh khối và sản xuất chế phẩm sinh học từ chủng VKQH tía chi Rhodobacter.
Nhân nuôi đại trà và ứng dụng chủng VKQH tía chi Rhodobacter trong xử lý nước thải thực tế.